Carbonsäuren: Wichtige Funktionelle Gruppen der organischen Chemie
Entdecke die faszinierende Welt der Carbonsäuren, ihre Eigenschaften, Vorkommen und Bedeutung im Alltag, der Biochemie und Industrie.
Was sind Carbonsäuren?
Carbonsäuren gehören zu den wichtigsten funktionellen Gruppen in der organischen Chemie. Sie sind durch die Carboxylgruppe (-COOH) gekennzeichnet, die aus einer Carbonylgruppe (C=O) und einer Hydroxylgruppe (-OH) besteht. Die allgemeine Formel für Carbonsäuren lautet \(\ce{R-COOH}\), wobei R einen Alkylrest oder Arylrest darstellt.
Carbonsäuren zeichnen sich durch ihre Fähigkeit aus, in wässrigen Lösungen Protonen abzugeben (Säuren nach Brønsted-Lowry). Sie bilden in Wasser ein Gleichgewicht: \(\ce{RCOOH + H2O <=> RCOO- + H3O+}\). Diese Reaktion ist für ihre charakteristischen Eigenschaften wie sauren Geschmack, pH-Wert und Reaktivität verantwortlich.
1. Vorkommen und Bedeutung
Carbonsäuren kommen in der Natur weit verbreitet vor und spielen eine wichtige Rolle in vielen biologischen Prozessen:
- Natürliche Quellen: Essigsäure in Essig, Citronensäure in Zitrusfrüchten, Milchsäure in saurer Milch
- Fettsäuren: Bestandteile von Fetten und Ölen, wichtig für die Zellmembranstruktur
- Stoffwechselprozesse: Carbonsäuren wie Citronensäure sind zentrale Moleküle im Citratzyklus
- Früchte und Pflanzen: Verantwortlich für den sauren Geschmack vieler Früchte
- Industrielle Anwendungen: Grundbausteine für Polymere, Lösungsmittel und Pharmazeutika
Ameisensäure
Essigsäure
Die unterschiedlichen Carbonsäuren haben jeweils eigene Charakteristika und Anwendungsbereiche, von der Lebensmittelkonservierung über medizinische Anwendungen bis hin zur chemischen Synthese.
2. Bedeutung für den Menschen
Lebensmittel
Carbonsäuren verleihen vielen Lebensmitteln ihren charakteristischen Geschmack. Essigsäure in Essig, Citronensäure in Zitrusfrüchten und Milchsäure in Joghurt sind nur einige Beispiele.
Industrielle Anwendungen
Viele Carbonsäuren dienen als Ausgangsverbindungen für die Herstellung von Polymeren, Farbstoffen, Arzneimitteln und Kosmetika. Essigsäure ist beispielsweise ein wichtiges Reagenz in der chemischen Industrie.
Körperfunktionen
Im menschlichen Körper spielen Carbonsäuren eine entscheidende Rolle im Stoffwechsel. Die Fettsäuren dienen als Energiespeicher, während Aminosäuren die Bausteine der Proteine sind.
Wichtig zu wissen
Obwohl Carbonsäuren in vielen Lebensmitteln natürlich vorkommen, können konzentrierte Carbonsäuren ätzend wirken und die Haut reizen. Im Labor und in der Industrie sollte stets mit entsprechender Schutzausrüstung gearbeitet werden.
Carbonsäuren sind in unserem Alltag allgegenwärtig. Von der Konservierung von Lebensmitteln über Reinigungsmittel bis hin zu Medikamenten begegnen uns diese vielseitigen Verbindungen täglich in unterschiedlichsten Formen.
3. Besondere Eigenschaften der Carbonsäuren
3.1 Wasserstoffbrückenbindungen und Dimerisierung
Eine besondere Eigenschaft der Carbonsäuren ist ihre Fähigkeit, untereinander Wasserstoffbrückenbindungen zu bilden. In der Reinsubstanz liegen Carbonsäuren oft als Dimere vor, wobei zwei Moleküle durch zwei Wasserstoffbrückenbindungen miteinander verbunden sind.
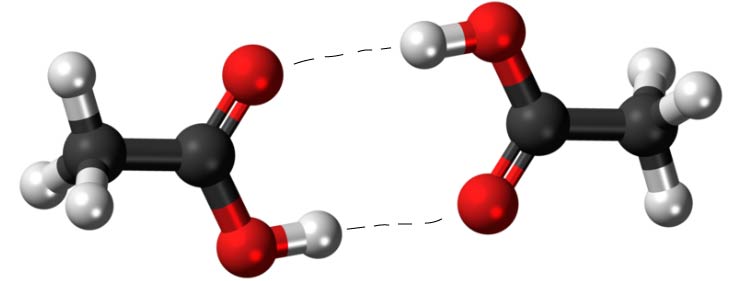
Ethansäure-Dimer mit Wasserstoffbrückenbindungen zwischen den Molekülen
Warum sind Wasserstoffbrückenbindungen wichtig?
Die Bildung von Dimeren durch Wasserstoffbrückenbindungen erklärt die unerwartet hohen Siedepunkte der Carbonsäuren im Vergleich zu anderen organischen Verbindungen mit ähnlichem Molekulargewicht. Die starken intermolekularen Wechselwirkungen erfordern mehr Energie zum Verdampfen.
3.2 Siedepunkte im Vergleich zu Alkanen
Die Siedetemperaturen von Carbonsäuren sind deutlich höher als die von entsprechenden Alkanen mit gleicher Kohlenstoffanzahl. Dies ist auf die Wasserstoffbrückenbindungen zurückzuführen, die zwischen den Carbonsäuremolekülen auftreten.
Interaktives Tool: Siedetemperaturen im Vergleich
Erkunde den Zusammenhang zwischen Kettenlänge und Siedetemperatur. Vergleiche die Siedepunkte von Carbonsäuren, Alkanen und Alkoholen.
Einfluss der Dimerisierung auf den Siedepunkt
Die Dimerisierung der Carbonsäuren durch Wasserstoffbrückenbindungen führt zu einer Verdoppelung der effektiven Molekülmasse. Zudem bildet sich ein stabiler, ringförmiger Komplex, der viel Energie benötigt, um aufzubrechen. Diese Faktoren führen zu den unerwartet hohen Siedepunkten der Carbonsäuren.
Beispiel: Essigsäure (C₂H₄O₂, M = 60 g/mol) hat einen Siedepunkt von 118°C, während Propan (C₃H₈, M = 44 g/mol) bereits bei -42°C siedet!
3.3 Säurestärke und pKs-Werte
Carbonsäuren sind schwache bis mittelstarke Säuren. Ihre Säurestärke wird durch den pKs-Wert charakterisiert, der ein Maß für die Neigung ist, ein Proton abzugeben. Je kleiner der pKs-Wert, desto stärker ist die Säure.
pKs-Werte wichtiger Carbonsäuren
| Carbonsäure | Formel | pKs-Wert | Dissoziationsgrad (0,1M) |
|---|---|---|---|
| Methansäure (Ameisensäure) | HCOOH | 3,75 | ≈ 6,1% |
| Ethansäure (Essigsäure) | CH₃COOH | 4,76 | ≈ 2,2% |
| Propansäure | C₂H₅COOH | 4,87 | ≈ 2,0% |
| Benzoesäure | C₆H₅COOH | 4,20 | ≈ 3,9% |
| Trichloressigsäure | CCl₃COOH | 0,66 | ≈ 69% |
Die Säurestärke wird durch die Stabilität des gebildeten Carboxylat-Anions beeinflusst. Elektronenziehende Gruppen in der Nähe der Carboxylgruppe erhöhen die Säurestärke, da sie die negative Ladung im Anion stabilisieren.
3.4 Elektrische Leitfähigkeit von Carbonsäuren
Carbonsäuren sind in reiner Form nicht elektrisch leitfähig. In wässriger Lösung dissoziieren sie teilweise in Ionen und ermöglichen dadurch eine schwache bis mäßige elektrische Leitfähigkeit, abhängig vom Dissoziationsgrad.
Interaktives Experiment: Leitfähigkeit von Carbonsäuren
Beobachte, wie verschiedene Carbonsäuren in Wasser dissoziieren und elektrischen Strom leiten. Die Bildung von Ionen ist entscheidend für die Leitfähigkeit.
Dissoziationsgleichgewicht
Carbonsäuren stellen ein Gleichgewicht in wässriger Lösung ein:
Der Dissoziationsgrad hängt vom pKs-Wert der Säure und ihrer Konzentration ab. Bei typischen Carbonsäuren wie Essigsäure liegen in einer 0,1-molaren Lösung nur etwa 1-5% der Moleküle dissoziiert vor.
4. Reaktionen von Carbonsäuren
4.1 Säure-Base-Reaktionen
Die charakteristischste Reaktion von Carbonsäuren ist die Protonenübertragung. Carbonsäuren reagieren mit Basen wie Natriumhydroxid oder Ammoniak unter Bildung von Salzen:
Protonenübertragung
Bei der Reaktion mit einer Base gibt die Carbonsäure ihr Proton ab und bildet ein Carboxylat-Anion.
Leitfähigkeitsexperiment
Die Bildung von Ionen durch Dissoziation ermöglicht die elektrische Leitfähigkeit.
4.2 Veresterung
Carbonsäuren reagieren mit Alkoholen unter Bildung von Estern. Diese Reaktion wird als Veresterung bezeichnet und läuft meist unter Anwesenheit eines sauren Katalysators ab:
Ester sind für ihre angenehmen Gerüche bekannt und finden Anwendung in Parfums, Aromastoffen und als Lösungsmittel.
4.3 Weitere wichtige Reaktionen
- Reduktion: Carbonsäuren können zu Alkoholen reduziert werden
- Bildung von Säurehalogeniden: Reaktion mit SOCl₂, PCl₃ oder PCl₅
- Bildung von Amiden: Reaktion mit Ammoniak oder Aminen
- Decarboxylierung: Abspaltung von CO₂ unter bestimmten Bedingungen
5. Wichtige Carbonsäuren in Natur und Technik
Milchsäure
2-Hydroxypropansäure, entsteht bei Milchsäuregärung. Wichtig in Lebensmitteln, Kosmetik und Polymeren (PLA).
Äpfelsäure
2-Hydroxybernsteinsäure, kommt in Äpfeln und vielen anderen Früchten vor. Wichtig als Säuerungsmittel in Lebensmitteln.
Zitronensäure
Eine Tricarbonsäure, die in Zitrusfrüchten vorkommt. Zentrale Rolle im Citratzyklus und Verwendung als Konservierungsmittel.
Weitere wichtige Carbonsäuren
- Oxalsäure - Kommt in Rhabarber und Spinat vor, wird als Bleichmittel verwendet
- Benzoesäure - Natürlich in Beeren vorkommend, wichtiges Konservierungsmittel
- Fettsäuren - Langkettige Carbonsäuren, wichtige Bestandteile von Fetten und Ölen
- Ascorbinsäure - Vitamin C, wichtiges Antioxidans und Nahrungsergänzungsmittel
- Acetylsalicylsäure - Besser bekannt als Aspirin, wirkt schmerzlindernd und fiebersenkend
Quiz: Carbonsäuren
Teste dein Wissen über Carbonsäuren mit diesem interaktiven Quiz!