Biomoleküle - Die Bausteine des Lebens
Entdecke die faszinierende Welt der DNA, Proteine und der molekularen Kräfte, die sie zusammenhalten – Ein Schlüssel zum Verständnis biologischer Systeme
1. Einführung in die Welt der Biomoleküle
Biomoleküle sind die chemischen Grundbausteine allen Lebens auf unserem Planeten. Diese faszinierenden Moleküle tragen die genetische Information, bauen unsere Zellen auf, katalysieren biochemische Reaktionen und ermöglichen die erstaunliche Vielfalt des Lebens.
Die vier Hauptklassen der Biomoleküle
- Nukleinsäuren: DNA und RNA - Träger der genetischen Information
- Proteine: Die Arbeiter der Zelle - Enzyme, Strukturproteine, Transportproteine
- Kohlenhydrate: Energiespeicher und Strukturelemente
- Lipide: Zellmembranen, Energiespeicher, Signalmoleküle
Was macht Biomoleküle so besonders?
Biomoleküle zeichnen sich durch einige besondere Eigenschaften aus:
- Hochgradige Spezifität - jedes Molekül erfüllt eine bestimmte Funktion
- Selbstorganisation - sie können komplexe Strukturen bilden
- Information - sie codieren und übertragen Informationen
- Katalytische Aktivität - sie können chemische Reaktionen beschleunigen
- Adaption - sie können sich an Umweltveränderungen anpassen
Biomoleküle - Die Chemie des Lebens
Alle Biomoleküle bestehen aus wenigen Grundelementen:
- C (Kohlenstoff): Bildet das Grundgerüst aller organischen Moleküle
- H (Wasserstoff): Füllt die Valenzen des Kohlenstoffs auf
- O (Sauerstoff): Wichtig für funktionelle Gruppen wie -OH, -COOH
- N (Stickstoff): Essentiell für Aminogruppen, Basen der DNA
- P (Phosphor): Zentraler Bestandteil von ATP, DNA, RNA
- S (Schwefel): Bildet Disulfidbrücken in Proteinen
Aus diesen sechs Elementen entsteht die unglaubliche Vielfalt aller Lebewesen!
2. DNA - Der genetische Bauplan
Die Desoxyribonukleinsäure (DNA) ist das Molekül, das die genetischen Informationen aller Lebewesen trägt. Die DNA ist wie ein Bauplan, der die Anleitung zum Bau und zur Funktion einer Zelle enthält.
Aufbau der DNA
Die DNA besteht aus:
- Nukleotiden als Grundbausteine, die jeweils enthalten:
- Eine Phosphatgruppe
- Einen Zucker (Desoxyribose)
- Eine Stickstoffbase
- Vier verschiedenen Basen:
- Adenin und Guanin (Purinbasen)
- Thymin und Cytosin (Pyrimidinbasen)
- Einem Zucker-Phosphat-Rückgrat, das die Nukleotide verbindet
Die Doppelhelix
Die DNA liegt als Doppelhelix vor, wobei:
- Zwei DNA-Stränge antiparallel verlaufen
- Die Stränge durch Wasserstoffbrückenbindungen zwischen komplementären Basen verbunden sind
- Adenin (A) immer mit Thymin (T) paart (2 Wasserstoffbrücken)
- Guanin (G) immer mit Cytosin (C) paart (3 Wasserstoffbrücken)
- Die Basen ins Innere der Helix zeigen, während das Zucker-Phosphat-Rückgrat außen liegt
Basenpaarung in der DNA
Die spezifische Basenpaarung ist entscheidend für die Funktion der DNA:
- A=T: Adenin bildet 2 Wasserstoffbrücken mit Thymin
- G≡C: Guanin bildet 3 Wasserstoffbrücken mit Cytosin
Diese komplementäre Basenpaarung ermöglicht:
- Die Replikation - exakte Verdoppelung der DNA
- Die Transkription - Umschreiben von DNA in RNA
- Die DNA-Reparatur - Korrektur von Fehlern im Erbgut
DNA-Doppelhelix Animation
Diese Animation zeigt den Aufbau der DNA-Doppelhelix mit ihren komplementären Basenpaaren, dem Zucker-Phosphat-Rückgrat und den Wasserstoffbrückenbindungen zwischen den Basen.
3. Intermolekulare Kräfte und Bindungen
Die dreidimensionale Struktur und Funktion von Biomolekülen wird maßgeblich durch verschiedene Bindungsarten bestimmt. Diese reichen von starken kovalenten Bindungen bis hin zu schwachen intermolekularen Wechselwirkungen.
Kovalente Bindungen
Diese starken Bindungen bilden das Grundgerüst der Biomoleküle:
- Peptid-/Amidbindungen: Verbinden Aminosäuren in Proteinen
- Phosphodiesterbindungen: Verbinden Nukleotide in DNA und RNA
- Glycosidische Bindungen: Verbinden Zuckermoleküle in Kohlenhydraten
- Disulfidbrücken: Verbinden Cysteinreste in Proteinen
Nicht-kovalente Wechselwirkungen
Diese schwächeren Kräfte sind entscheidend für die räumliche Struktur:
- Wasserstoffbrückenbindungen: Zwischen polaren Gruppen (NH, OH)
- Ionische Wechselwirkungen: Zwischen gegensätzlich geladenen Gruppen
- Van-der-Waals-Kräfte: Schwache Anziehung zwischen unpolaren Bereichen
- Hydrophobe Wechselwirkungen: Tendenz unpolarer Gruppen, sich zusammenzulagern
Van-der-Waals-Kräfte
Van-der-Waals-Kräfte sind schwache Anziehungskräfte zwischen Molekülen, die auf kurzzeitigen Ladungsverschiebungen in der Elektronenhülle beruhen:
- Dipol-Dipol-Wechselwirkungen: Zwischen permanenten Dipolen
- Dipol-induzierter-Dipol-Wechselwirkungen: Ein permanenter Dipol induziert einen Dipol in einem unpolaren Molekül
- London-Dispersionskräfte: Zwischen temporär induzierten Dipolen
Obwohl einzelne Van-der-Waals-Kräfte sehr schwach sind, können sie in großer Zahl beträchtliche Wirkung entfalten!
Wasserstoffbrückenbindungen
Wasserstoffbrückenbindungen entstehen, wenn ein Wasserstoffatom, das kovalent an ein elektronegatives Atom (meist O, N, F) gebunden ist, mit einem anderen elektronegativen Atom wechselwirkt:
- Stärke: 4-40 kJ/mol (stärker als Van-der-Waals-Kräfte, schwächer als kovalente Bindungen)
- Intramolekulare H-Brücken: Innerhalb eines Moleküls (z.B. bei der α-Helix)
- Intermolekulare H-Brücken: Zwischen verschiedenen Molekülen (z.B. zwischen DNA-Strängen)
Wasserstoffbrückenbindungen sind entscheidend für die Stabilität von DNA, Proteinen und die besonderen Eigenschaften von Wasser!
Disulfidbrücken
Disulfidbrücken sind kovalente Bindungen zwischen Schwefelatomen zweier Cystein-Seitenketten:
- Chemische Formel: R-S-S-R
- Bildung: Durch Oxidation von Thiolgruppen (-SH)
- Stärke: ~200-300 kJ/mol (deutlich stärker als H-Brücken)
Disulfidbrücken verleihen Proteinen zusätzliche Stabilität und sind besonders wichtig in extrazellulären Proteinen wie Antikörpern oder Verdauungsenzymen.
Molekulare Bindungen Animation
Diese Animation zeigt die verschiedenen Bindungsarten in Biomolekülen - von kovalenten Bindungen wie Disulfidbrücken bis hin zu schwächeren intermolekularen Kräften wie Wasserstoffbrücken und Van-der-Waals-Kräften.
4. Aminosäuren und Proteinstruktur
Proteine sind vielseitige Biomoleküle, die aus Aminosäuren aufgebaut sind und eine Vielzahl von Funktionen im Organismus erfüllen - von strukturgebenden Eigenschaften bis hin zu katalytischen Aktivitäten als Enzyme.
Aminosäuren - Die Bausteine der Proteine
Alle Aminosäuren haben eine gemeinsame Grundstruktur:
- Eine Carboxylgruppe (-COOH)
- Eine Aminogruppe (-NH₂)
- Ein zentrales Kohlenstoffatom (α-C)
- Eine variable Seitenkette (R-Gruppe)
Die 20 proteinogenen Aminosäuren unterscheiden sich nur in ihrer R-Gruppe!
Eigenschaften der Aminosäuren
Die R-Gruppen bestimmen die Eigenschaften der Aminosäuren:
- Unpolare (hydrophobe) Aminosäuren: Ala, Val, Leu, Ile, Met, Phe, Pro
- Polare (hydrophile) Aminosäuren: Ser, Thr, Asn, Gln, Tyr, Cys
- Saure Aminosäuren: Asp, Glu
- Basische Aminosäuren: Lys, Arg, His
- Spezielle Aminosäuren: Gly (ohne Seitenkette), Cys (bildet Disulfidbrücken)
Die Peptid-/Amidbindung
Aminosäuren werden durch Peptid-/Amidbindungen zu Ketten (Peptiden) verbunden:
- Die Carboxylgruppe einer Aminosäure reagiert mit der Aminogruppe der nächsten Aminosäure
- Dabei wird ein Wassermolekül abgespalten (Kondensationsreaktion)
- Die entstehende Bindung (C=O···HN) hat partiellen Doppelbindungscharakter und ist planar
Die Peptid-/Amidbindung ermöglicht den Aufbau von Proteinen mit tausenden von Aminosäuren!
Die vier Strukturebenen der Proteine
Primärstruktur
Die Aminosäuresequenz - die Abfolge der Aminosäuren in der Kette:
- Wird durch die genetische Information in der DNA festgelegt
- Wird durch Peptid-/Amidbindungen stabilisiert
- Bestimmt alle höheren Strukturebenen
Sekundärstruktur
Lokale, regelmäßige Strukturen innerhalb der Polypeptidkette:
- α-Helix: Spiralförmige Struktur, durch H-Brücken stabilisiert
- β-Faltblatt: Parallele oder antiparallele Stränge, durch H-Brücken verbunden
- Loops und Turns: Verbinden Helices und Faltblätter
Tertiärstruktur
Die dreidimensionale Faltung der gesamten Polypeptidkette:
- Stabilisiert durch Wasserstoffbrücken zwischen Aminosäuren
- Ionische Wechselwirkungen zwischen geladenen Seitenketten
- Disulfidbrücken zwischen Cystein-Resten
- Hydrophobe Wechselwirkungen zwischen unpolaren Seitenketten
- Van-der-Waals-Kräfte zwischen nahegelegenen Atomen
Quartärstruktur
Die Zusammenlagerung mehrerer Polypeptidketten (Untereinheiten):
- Nicht alle Proteine haben eine Quartärstruktur
- Stabilisiert durch die gleichen Kräfte wie die Tertiärstruktur
- Beispiele: Hämoglobin (4 Untereinheiten), Antikörper, Kollagen
Wichtig: Die Rolle der Bindungsarten
Die verschiedenen Bindungsarten tragen unterschiedlich zur Proteinstabilität bei:
- Kovalente Bindungen (Peptid-, Disulfid-): sehr stark, bestimmen das Grundgerüst
- Wasserstoffbrückenbindungen: mittelstark, formen Sekundärstrukturelemente
- Ionische und hydrophobe Wechselwirkungen: mittlere Stärke, wichtig für Tertiärstruktur
- Van-der-Waals-Kräfte: schwach, aber in großer Zahl bedeutsam für die Feinabstimmung
Die Summe aller nicht-kovalenten Wechselwirkungen bestimmt die endgültige Proteinstruktur!
Proteinstruktur Animation
Diese Animation zeigt die Faltung einer Polypeptidkette von der Primär- bis zur Tertiärstruktur und die Rolle verschiedener Bindungsarten bei der Stabilisierung der dreidimensionalen Struktur.
5. Von der DNA zum Protein
Der Informationsfluss von der DNA zum Protein ist ein fundamentaler Prozess in allen Lebewesen, der als "zentrales Dogma der Molekularbiologie" bekannt ist.
Die Transkription
Die Umschreibung der DNA-Information in RNA:
- Findet im Zellkern statt
- Ein DNA-Strang dient als Vorlage (Template)
- Das Enzym RNA-Polymerase synthetisiert einen komplementären RNA-Strang
- Die Basenpaarung lautet: A-U, G-C (statt A-T)
- Das Resultat ist die messenger RNA (mRNA)
Die Translation
Die Übersetzung der RNA-Information in ein Protein:
- Findet im Cytoplasma an den Ribosomen statt
- Die mRNA wird in Tripletts (Codons) gelesen
- Jedes Codon kodiert für eine Aminosäure (genetischer Code)
- tRNAs bringen die passenden Aminosäuren
- Die Aminosäuren werden durch Peptid-/Amidbindungen verknüpft
Die Proteinfaltung
Nach der Synthese faltet sich die Polypeptidkette in ihre funktionale Form:
- Die Primärstruktur bestimmt die Faltung
- Die Faltung wird durch molekulare Chaperone unterstützt
- Nicht-kovalente Wechselwirkungen stabilisieren die Struktur
- Disulfidbrücken bilden sich in oxidativer Umgebung
- Fehlfaltungen können zu Protein-Aggregaten und Krankheiten führen
Die korrekte Faltung ist entscheidend für die Funktion des Proteins!
Beispiel: Insulin
Das Hormon Insulin zeigt beispielhaft die Bedeutung aller Strukturebenen und Bindungsarten:
- Primärstruktur: 51 Aminosäuren in zwei Ketten (A: 21, B: 30)
- Sekundärstruktur: α-Helices in beiden Ketten
- Tertiärstruktur: Kompakte 3D-Faltung
- Disulfidbrücken: Drei Brücken (zwei zwischen A- und B-Kette, eine innerhalb der A-Kette)
- Quartärstruktur: Bildung von Dimeren und Hexameren für die Speicherung
Durch diese Strukturmerkmale kann Insulin seinen Insulinrezeptor erkennen und die Zellantwort auslösen.
6. Übungen und Aufgaben
Übung 1: DNA-Basenpaare
Vervollständige die fehlenden komplementären Basen in dieser DNA-Sequenz:
Tipp: Denke an die komplementäre Basenpaarung: A-T und G-C.
Übung 2: Bindungsarten-Zuordnung
Ziehe die molekularen Bindungen zu den passenden Beschreibungen:
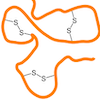
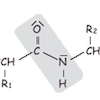
Schwache Anziehungskräfte zwischen unpolaren Molekülteilen:
Anziehung zwischen einem partiell positiven H-Atom und einem elektronegativen Atom:
Kovalente Bindung zwischen zwei Schwefelatomen in Proteinen:
Amidbindung, die Aminosäuren in Proteinen verbindet:
Übung 3: Aminosäuren und Proteinfaltung Quiz
7. Zusammenfassung
Die wichtigsten Bindungsarten in Biomolekülen
- Kovalente Bindungen: Peptid-/Amidbindungen, Disulfidbrücken
- Wasserstoffbrückenbindungen: DNA-Doppelhelix, Proteinsekundärstruktur
- Ionische Wechselwirkungen: Zwischen geladenen Gruppen
- Van-der-Waals-Kräfte: Zwischen unpolaren Molekülteilen
- Hydrophobe Wechselwirkungen: "Zusammenklumpen" unpolarer Gruppen
Von der DNA zum Protein
- DNA: Speicherung der genetischen Information
- Transkription: Umschreibung von DNA in mRNA
- Translation: Übersetzung der mRNA in Aminosäuresequenz
- Proteinfaltung: Ausbildung der dreidimensionalen Struktur
- Funktion: Ausübung der spezifischen Proteinfunktion
Klausurtipps:
- Die Basenpaarung in DNA ist immer A-T und G-C, wobei G-C drei Wasserstoffbrücken und A-T zwei Wasserstoffbrücken bildet.
- Die Peptidbindung ist eine Amidbindung zwischen der Carboxylgruppe einer Aminosäure und der Aminogruppe der nächsten Aminosäure.
- Van-der-Waals-Kräfte sind die schwächsten intermolekularen Kräfte, aber in großer Zahl wichtig für die Proteinstabilität.
- Wasserstoffbrücken sind entscheidend für die DNA-Struktur und Proteinsekundärstruktur.
- Disulfidbrücken sind kovalente Bindungen zwischen Cystein-Resten und besonders wichtig für extrazelluläre Proteine.
- Die vier Strukturebenen der Proteine bauen aufeinander auf: Primär → Sekundär → Tertiär → Quartär.