Kalorimetrie
Fortgeschrittene kalorimetrische Messungen in der Chemie - Lerne, wie professionelle Kalorimeter funktionieren und wie die Wärmekapazität des Messgeräts berücksichtigt wird.
1. Das Kalorimeter: Ein präzises Messinstrument
In der vorherigen Lektion haben wir grundlegende kalorimetrische Experimente kennengelernt. Dabei haben wir vereinfacht angenommen, dass die gesamte freigesetzte Wärme vom Wasser aufgenommen wird. In präziseren Messungen müssen wir jedoch berücksichtigen, dass auch das Messgerät selbst - das Kalorimeter - einen Teil der Wärmeenergie aufnimmt.
Was ist ein Kalorimeter?
Ein Kalorimeter ist ein spezielles Messgerät zur Bestimmung der bei einer Reaktion aufgenommenen oder abgegebenen Wärmeenergie:
- Thermisch isoliertes System (minimaler Wärmeaustausch mit der Umgebung)
- Präzise Temperaturmessung
- Bekannte Wärmekapazität des gesamten Systems
- Eingebautes Rührwerk für gleichmäßige Wärmeverteilung
Typen von Kalorimetern
Es gibt verschiedene Arten von Kalorimetern für unterschiedliche Anwendungen:
- Bombenkalorimeter: Für Verbrennungsreaktionen unter hohem Druck
- Reaktionskalorimeter: Für flüssige Reaktionssysteme
- Differentialkalorimeter (DSC): Für die Messung von Wärmeflüssen
- Isothermes Titrationskalorimeter: Für biochemische Prozesse
2. Die Wärmekapazität des Kalorimeters
Die Wärmekapazität eines Kalorimeters gibt an, wie viel Energie nötig ist, um das gesamte Kalorimeter (Gefäß, Thermometer, Rührer etc.) um 1 Kelvin zu erwärmen. Diese Gerätekonstante wird auch als Kalorimeterkonstante oder Wasserwert bezeichnet.
Berücksichtigung der Kalorimeterkonstante in der Wärmeenergie-Berechnung:
wobei:
- \(Q_{\text{ges}}\) = Gesamte Wärmeenergie in Joule (J)
- \(m_{\text{Wasser}}\) = Masse des Wassers in Kilogramm (kg)
- \(c_{\text{Wasser}}\) = spezifische Wärmekapazität von Wasser (4,184 J/(g·K))
- \(C_{\text{Kal}}\) = Kalorimeterkonstante in J/K
- \(\Delta T\) = Temperaturänderung in Kelvin (K) oder °C
Bestimmung der Kalorimeterkonstante
Um genaue Messungen durchführen zu können, muss zunächst die Kalorimeterkonstante bestimmt werden. Dies geschieht mit Hilfe einer Kalibrierungsmessung, bei der eine bekannte Wärmemenge zugeführt wird.
Methode 1: Elektrische Kalibrierung
Ein elektrischer Widerstand wird im Kalorimeter platziert und eine genau gemessene elektrische Energiemenge zugeführt:
(Spannung × Stromstärke × Zeit)
Anschließend wird die Kalorimeterkonstante bestimmt:
Methode 2: Chemische Kalibrierung
Eine Reaktion mit bekannter Reaktionsenthalpie (z.B. Neutralisation von Salzsäure mit Natronlauge) wird durchgeführt:
Dabei ist \(n\) die Stoffmenge und \(\Delta H_R\) die molare Reaktionsenthalpie der Kalibrierungsreaktion.
Kalorimeter-Animation: Messung einer exothermen Reaktion
Diese Animation zeigt den Aufbau und die Funktionsweise eines Kalorimeters bei der Messung einer exothermen Reaktion (Neutralisation von Säure und Base).
3. Präzise Messungen mit dem Kalorimeter
Die Verwendung eines Kalorimeters ermöglicht präzise Messungen der Reaktionswärme. Dabei ist es wichtig, verschiedene Faktoren zu berücksichtigen, um die Genauigkeit zu maximieren.
Experimentelles Vorgehen
- Kalibrierung des Kalorimeters (Bestimmung der Kalorimeterkonstante)
- Exakte Bestimmung der eingesetzten Stoffmengen
- Messung der Anfangstemperatur (nach Temperaturausgleich)
- Durchführung der Reaktion unter ständigem Rühren
- Beobachtung des Temperaturverlaufs bis zum Erreichen des Maximums/Minimums
- Berücksichtigung von Wärmeverlusten (ggf. Extrapolation des Temperaturverlaufs)
Wichtig für präzise Messungen
Für genaue Messergebnisse sollten folgende Faktoren beachtet werden:
- Thermische Isolierung des Kalorimeters überprüfen
- Rührer kontinuierlich mit konstanter Geschwindigkeit betreiben
- Alle Komponenten vor Reaktionsbeginn auf gleiche Temperatur bringen
- Temperaturmessfühler kalibrieren
- Bei längeren Messungen Wärmeverluste durch mathematische Korrektur berücksichtigen
Berechnung der Reaktionsenthalpie unter Berücksichtigung des Kalorimeters:
Dabei ist \(n\) die umgesetzte Stoffmenge des Reaktanden (in mol).
4. Praktisches Beispiel: Neutralisationsreaktion
Die Neutralisation einer starken Säure mit einer starken Base ist ein klassisches Beispiel für eine exotherme Reaktion, die gut mit einem Kalorimeter gemessen werden kann.
Reaktionsgleichung:
Beispielrechnung mit Kalorimeter:
Angenommen, wir haben folgende Messwerte:
- 50 mL 1,0 M HCl-Lösung
- 50 mL 1,0 M NaOH-Lösung
- Anfangstemperatur beider Lösungen: 22,0°C
- Endtemperatur nach der Reaktion: 28,5°C
- Kalorimeterkonstante: \(C_{\text{Kal}} = 75\) J/K
Berechnung:
- Gesamtmasse des Wassers: \(m_{\text{Wasser}} = 100\) g (näherungsweise, da verdünnte Lösungen)
- Temperaturänderung: \(\Delta T = 28{,}5\text{°C} - 22{,}0\text{°C} = 6{,}5\) K
- Umgesetzte Stoffmenge: \(n = 0{,}05\,\text{L} \cdot 1{,}0\,\text{mol/L} = 0{,}05\) mol
-
Gesamte Wärmeenergie:
\[\begin{aligned} Q_{\text{ges}} &= (m_{\text{Wasser}} \cdot c_{\text{Wasser}} + C_{\text{Kal}}) \cdot \Delta T \\ &= (100\,\text{g} \cdot 4{,}184\,\text{J/(g·K)} + 75\,\text{J/K}) \cdot 6{,}5\,\text{K} \\ &= 3207{,}1\,\text{J} \end{aligned}\]
-
Molare Reaktionsenthalpie:
\[ \Delta H_R = -\frac{Q_{\text{ges}}}{n} = -\frac{3207{,}1\,\text{J}}{0{,}05\,\text{mol}} = -64\,142\,\text{J/mol} = -64{,}1\,\text{kJ/mol} \]
Der Literaturwert für die Neutralisationsenthalpie beträgt etwa -57,3 kJ/mol. Die Abweichung kann durch Wärmeverluste und Messungenauigkeiten erklärt werden.
5. Eigene Berechnung
Berechne selbst die Reaktionsenthalpie für verschiedene Messwerte unter Berücksichtigung der Kalorimeterkonstante:
Interaktiver Rechner
6. Fortgeschrittene Kalorimetrie: Wärmeverlustkorrektur
Bei längeren Messungen kann der Wärmeverlust an die Umgebung nicht vernachlässigt werden. In professionellen Messungen wird dieser Faktor durch mathematische Verfahren korrigiert.
Korrekturmethoden
Regnault-Pfaundler-Methode
Eine klassische Methode zur Korrektur von Wärmeverlusten durch Extrapolation der Temperaturkurven vor und nach der Reaktion.
Dickinson-Methode
Bestimmung des Temperaturmaximums/-minimums durch graphische Extrapolation der Temperaturkurve.
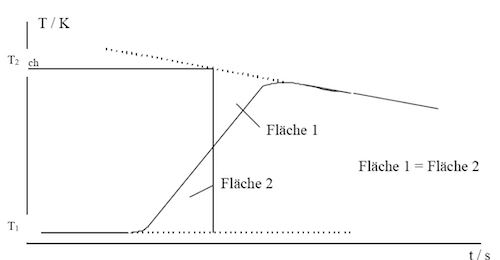
Die moderne Kalorimetrie nutzt computergestützte Auswerteverfahren, um Wärmeverluste zu korrigieren und die Genauigkeit der Messungen weiter zu erhöhen. Dabei werden Differentialgleichungen gelöst, um den Wärmefluss zwischen Kalorimeter und Umgebung zu modellieren.
7. Anwendungen der präzisen Kalorimetrie
Die exakte Bestimmung von Reaktionswärmen und Wärmekapazitäten ist in vielen Bereichen von Wissenschaft und Technik wichtig.
Wissenschaftliche Anwendungen
- Bestimmung thermodynamischer Daten für die chemische Datenbank
- Untersuchung von Protein-Ligand-Wechselwirkungen in der Biochemie
- Messung von Phasenübergängen in Materialien
- Bestimmung von Reinheitsgraden chemischer Substanzen
Technische Anwendungen
- Bestimmung des Brennwerts von Kraftstoffen und Nahrungsmitteln
- Qualitätskontrolle in der chemischen Industrie
- Sicherheitsuntersuchungen für exotherme Reaktionen
- Optimierung von Verbrennungsprozessen
8. Übungsaufgaben zur Kalorimetrie
Übungsaufgabe 1: Bestimmung der Kalorimeterkonstante
Ein elektrischer Heizwiderstand wird in ein Kalorimeter mit 250 g Wasser gegeben. Bei einer angelegten Spannung von 12 V und einer Stromstärke von 0,5 A steigt die Temperatur in 5 Minuten von 20,0°C auf 23,5°C. Berechne die Kalorimeterkonstante.
Übungsaufgabe 2: Reaktionsenthalpie einer Verdünnungsreaktion
In einem Kalorimeter mit einer Kalorimeterkonstante von 120 J/K befinden sich 100 g Wasser bei 22,0°C. Nach Zugabe von 5,0 g konzentrierter Schwefelsäure (\(\ce{H2SO4}\)) steigt die Temperatur auf 35,2°C. Berechne die molare Verdünnungswärme der Schwefelsäure.